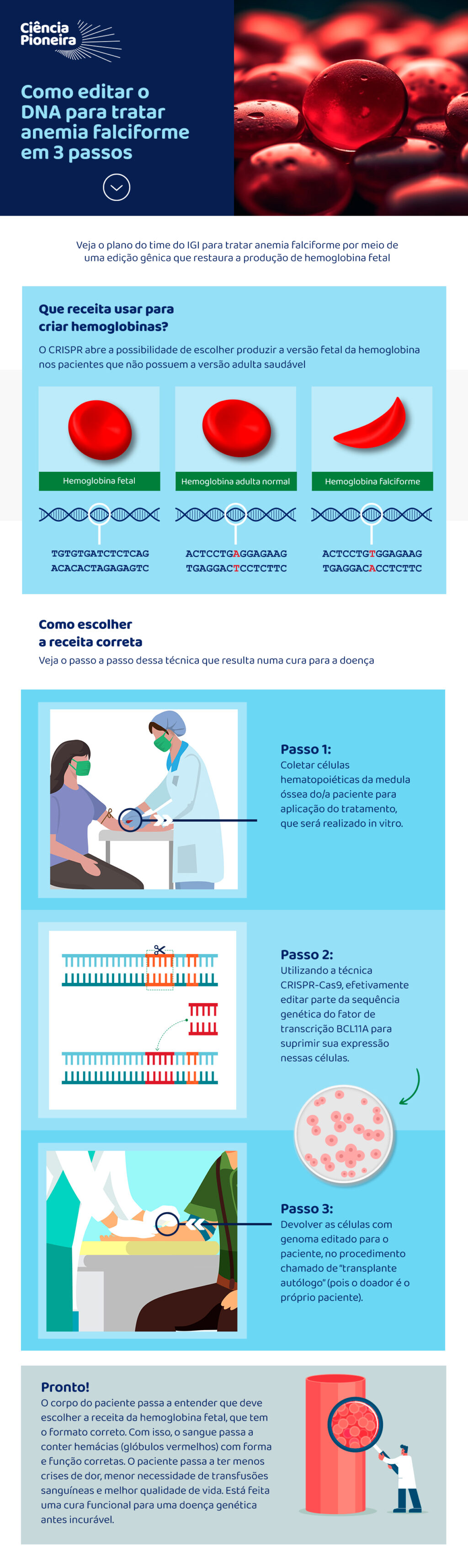
A anemia falciforme é um distúrbio genético hereditário causado por uma mutação única (SNP) no gene produtor da hemoglobina. A mutação em questão altera a forma de uma das proteínas da célula, o que resulta numa hemoglobina em formato de foice (daí o nome). Essa hemoglobina diferente, além de não ter a mesma capacidade da original de transportar oxigênio, é também mais rígida e tem uma maior tendência a se aglutinar e obstruir vasos sanguíneos (especialmente os mais estreitos), causando dores constantes, anemia, inchaço de mãos e pés e aumentando os riscos de infecções e AVC.
Os primeiros sintomas da doença começam a aparecer a partir dos cinco ou seis meses de idade. Ou seja, não acontecem durante a gestação ou mesmo nos primeiros meses após o nascimento. O motivo disso é que fetos e recém-nascidos têm uma hemoglobina diferente predominante no sangue: a hemoglobina fetal (conhecida como F).
A diferença da hemoglobina fetal para a adulta é que a primeira é formada por um par de proteínas conhecidas como alfa e um par de proteínas gama, enquanto a segunda associa um par de alfas com um par de betas. Na prática, o formato e a função são muito parecidos, especialmente quando comparados à versão alterada da doença falciforme.
Acontece que o gene que comanda a produção da hemoglobina fetal não é o mesmo que dá as instruções para a produção da forma adulta. O que ocorre é que o gene responsável pela forma fetal é desativado quando o gene da forma adulta começa a assumir o controle. E é aí que os sintomas começam nas pessoas que possuem duas cópias da variante patogênica.
O tratamento padrão para a anemia falciforme hoje é o uso de medicamentos como a hidroxiureia, que resulta justamente no aumento da proporção de hemoglobina fetal no sangue. Entretanto, nem todos os pacientes se beneficiam do uso desse medicamento e o mecanismo de ação exato dessa droga ainda é desconhecido, ao contrário dos efeitos colaterais, que são bem documentados.
É aí que chegamos na proposta do IGI, conforme mencionado nesta entrevista pelo fellow Bruno Solano, que trabalha com a bioquímica ganhadora do Prêmio Nobel de Química 2020, Jennifer Doudna. A Dra. Doudna ganhou o Nobel exatamente pela descoberta da técnica CRISPR, que permite editar o genoma e abre caminho para a cura de doenças genéticas. Bruno é um dos fellows que estão em treinamento com o time de Doudna por meio da parceria com a Ciência Pioneira. A chave está nas células tronco hematopoiéticas, aquelas que se localizam na medula óssea e dão origem a todas as outras células sanguíneas.
A técnica, que já foi analisada em outros estudos com camundongos e humanos, consiste em suprimir o fator de transcrição genética conhecido como BCL11A. Como BCL11A é responsável pela repressão do gene que codifica as proteínas da hemoglobina fetal, na prática, ela volta a ser produzida, o que pode resultar em uma melhora significativa ou até mesmo uma cura funcional para a doença, uma vez que o paciente passa a ter no sangue uma proporção maior de hemácias com a geometria normal, minimizando os riscos de tromboses e outros riscos associados à hemoglobina falcêmica.
Veja no infográfico abaixo o passo a passo dessa solução: